Multimodal Neuroimaging

Multimodal Neuroimaging
Group leader: Dr. Anne Maass
Störungen des episodischen Gedächtnisses sind ein frühes Anzeichen der Alzheimer Demenz, treten aber auch häufig bei gesunden älteren Menschen auf. Der Hippocampus und der angrenzende Entorhinale Cortex sind Strukturen im medialen Schläfenlappen unseres Gehirns, die für die Speicherung neuer Erlebnisse in unser Langzeitgedächtnis eine entscheidende Rolle spielen. Ablagerungen des Tau Proteins in Form von Neurofibrillen im Entorhinalen Cortex finden sich bei den meisten älteren Menschen, während die Ausbreitung der Tau Pathologie auf neokortikale Areale meist mit der Ablagerung von Aβ Plaques verbunden ist. Mit Hilfe von Tau- und Aβ-spezifischen PET (Positron Emission Tomographie) Markern können wir die regionale Ausbreitung von Tau Fibrillen und Amyloid Plaques im lebenden Menschen abbilden (Schöll, Maass et al, 2018; siehe Abb.1).
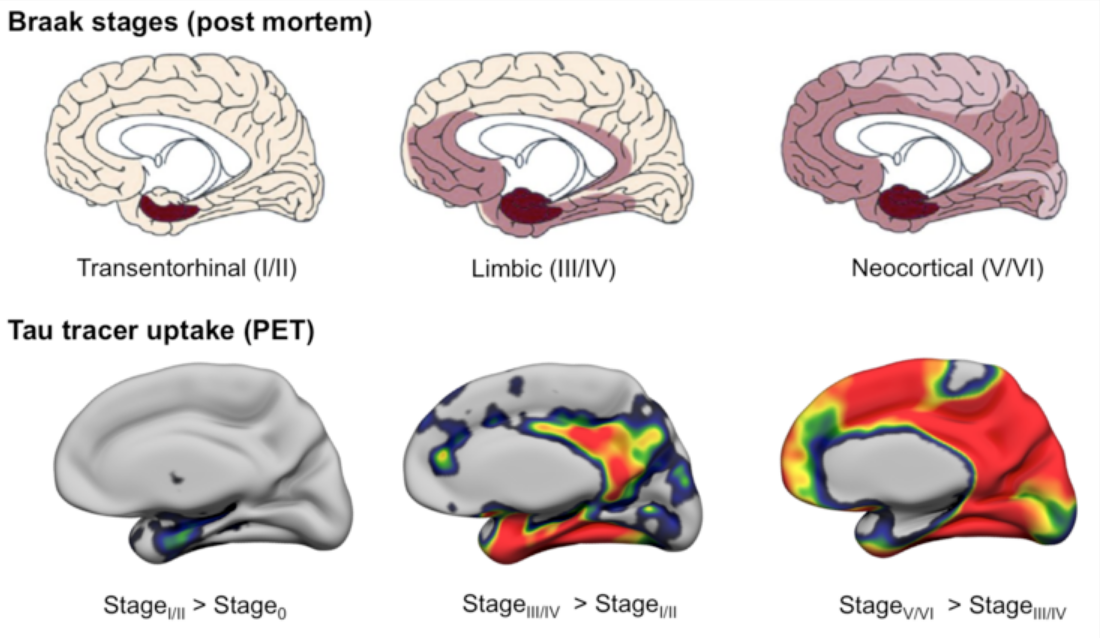
Abb. 1: In vivo Akkumulation von Tau Neurofibrillen gemessen mit PET gleicht ex vivo Stadien der Tau Pathologie in der Progression der Alzheimer Krankheit. In frühen Stadien (Braak I/II) finden sich Tau Neurofibrillen im Medialen Temporallappen und breiten sich im Verlauf der Krankheit auf limbische und höhere neokortikale Regionen aus. Quelle: “Biomarkers for tau pathology”. Schöll et al., 2018. Mol Cell Neurosci. Copyright 2018 by Elsevier Inc. Die Original-Abbildung der Braak Stadien ist zu finden in “Stages of the Pathologic Process in Alzheimer Disease: Age Categories From 1 to 100 Years,” (Braak et al., 2011). Copyright 2011 by Oxford University Press.
Daten von Tau PET Studien in klinisch gesunden älteren Probanden zeigen dabei, dass Entorhinale Tau Pathologie mit Gedächtnisproblemen assoziiert ist, unabhängig von Aβ Plaques (Maass et al., 2018; Abb.2). Ist diese „frühe“ Tau Pathologie ohne das Vorhandensein von Amyloid Plaques das Frühstadium der Alzheimer Krankheit? Welche Faktoren führen dazu, dass Tau Fibrillen sich auf höhere neokortikale Areale ausbreiten? Wie können einige Individuen ihre Gedächtnisleistung aufrecht erhalten, obwohl sie neuropathologische Veränderungen zeigen?
Mit Hilfe von multimodaler Bildgebung, die funktionelle und strukturelle MRT (Magnetresonanztomographie) mit molekularer Bildgebung (PET) kombiniert, versuchen wir zu verstehen, welche Gedächtnisnetzwerke im Alter und in neurodegenerativen Erkrankungen gestört sind. Die 7 Tesla Hochfeld- MRT ermöglicht es dabei, die funktionelle Anatomie des hippocampalen-entorhinalen Gedächtnisnetzwerkes mit hoher anatomischer Genauigkeit im Menschen zu untersuchen (Maass et al., 2014, Nat Commun). Ein Ziel ist es, sensitive und spezifische Imaging oder kognitive Marker für die Früherkennung der Alzheimer Demenz zu entwickeln.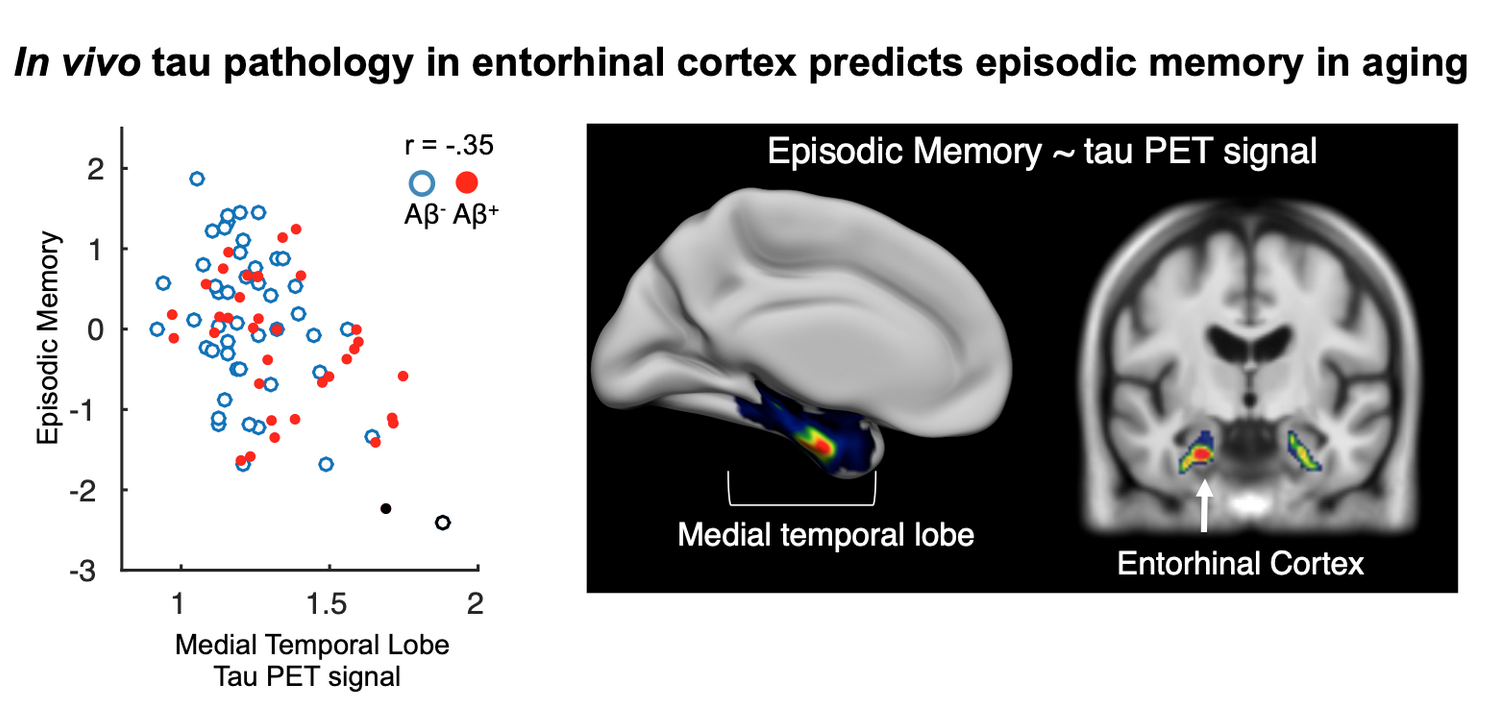
Abb. 2: Höheres Tau PET Signal (tracer: Flortaucipir) im Entorhinalen Cortex als Maß der Tau Pathologie ist verbunden mit schlechterem Episodischen Gedächtnis in kognitiv unbeeinträchtigten älteren Probanden. Quelle: “Biomarkers for tau pathology”. Schöll et al., 2018. Mol Cell Neurosci. Copyright 2018 by Elsevier Inc. Die Daten sind entnommen aus Maass et al., 2018 (J Neurosci)
Darüber hinaus, wollen wir besser verstehen, welche Faktoren Plastizität beeinflussen, um kognitive oder physische Trainingsinterventionen zu entwickeln, die der altersbedingten Abnahme der Gedächtnisleistung entgegenwirken. Frühere Studien am DZNE deuten darauf hin, dass Ausdauertraining auch im Alter die Durchblutung des Hippocampus verbessern kann, was positive Auswirkungen auf die Gedächtnisleistung hat (Maass et al., 2014, Mol Psychiatry). Weitere Studien sind jedoch nötig, um die Ursachen für die individuelle Variabilität neurovaskulärer Plastizität zu bestimmen.
Degrees
| 2011-2015 | PhD in Neuroscience, Otto-von-Guericke University Magdeburg | ||||||
| 2008-2011 | MSc in Integrative Neuroscience, Otto-von-Guericke University Magdeburg | ||||||
| 2005-2008 | BSc in Biochemistry, University Potsdam |
Major previous appointments
| since 2019 | Junior Group leader at DZNE Magdeburg | ||||||
| 2018-2019 | PostDoc at DZEN Magdeburg (with Prof. Emrah Düzel) | ||||||
| 2015-2018 | PostDoc at University of California, Berkeley (with Prof. William Jagust) |
Activities in the Scientific Community/ Professional Memberships
| since 2017 |
Honors and Awards
| 2017 | Alzheimer´s Association Award for Young Scientists | ||||||||||
| 2016 | 3-year PostDoc grant from the Helmholtz Association | ||||||||||
| 2015 | Empiris Award for Research in Brain Diseases |
- Dr. Ornella Billette
- Dr. Berta Garcia-Garcia
Original articles
- Baker SL, Maass A, Jagust WJ (2017) Considerations and code for partial volume correcting [18F]-AV-1451 tau PET data. Data in Brief15:648–657.Baker SL, Harrison TM, Maaß A, La Joie R, Jagust W. (2019) Effect of off-target binding on 18F-Flortaucipir variability in healthy controls across the lifespan. J Nucl Med
- Berron D, Neumann K, Maass A, Schütze H, Fliessbach K, Kiven V, Jessen F, Sauvage M, Kumaran D, Düzel E (2017) Age-related functional changes in domain-specific medial temporal lobe pathways. NeurobiolAging65:86–97.
- Berron D, Schütze H, Maass A, Cardenas-Blanco A, Kuijf HJ, Kumaran D, Düzel E (2016) Strong Evidence for Pattern Separation in Human Dentate Gyrus. J Neurosci36:7569–7579.
- Berron D, Vieweg P, Hochkeppler A, Pluta JB, Ding S-L, Maass A, Luther A, Xie L, Das SR, Wolk DA, Wolbers T, Yushkevich PA, Düzel E, Wisse LEM (2017) A protocol for manual segmentation of medial temporal lobe subregionsin 7 Tesla MRI. NeuroImage: Clinical15:466–482.
- Betts et al. (2019).Locus coeruleus imaging as a biomarker for noradrenergic dysfunction in neurodegenerative diseases. Brain(in press)
- Hämmerer D, Hopkins A, Betts MJ, Maaß A, Dolan RJ, Düzel E (2017) Emotional arousal and recognition memory are differentially reflected in pupil diameter responses during emotional memory for negative events in younger and older adults. Neurobiology of Aging58:129–139.
- Harrison TM, Maass A, Baker SL, Jagust WJ (2018) Brain morphology, cognition, and β-amyloid in older adults with superior memory performance. Neurobiol Aging67:162–170.
- Harrison TM, La Joie R, Maass A, Baker S, Swinnerton K, Fenton L, Mellinger TJ,. Rabinovici GD, Jagust WJ. (2019) Longitudinal tau accumulation and atrophy in normal aging and Alzheimer’s disease. Annals of Neurology
- La Joie R et al. (2018) Associations between [18F]AV1451 tau PET and CSF measures of tau pathology in a clinical sample.Neurology 90:e282–e290.
- Leal SL, Lockhart SN, Maass A, Bell RK, Jagust WJ (2018) Subthreshold Amyloid Predicts Tau Deposition in Aging. J Neurosci38:4482–4489.
- Maass A, Düzel S, Goerke M, Becke A, Sobieray U, Neumann K, Lövden M, Lindenberger U, Bäckman L, Braun-Dullaeus R, Ahrens D, Heinze H-J, Müller NG, Düzel E (2014a) Vascular hippocampal plasticity after aerobic exercise in older adults. Mol Psychiatry.
- Maass A, Schütze H, Speck O, Yonelinas A, Tempelmann C, Heinze H-J, Berron D, Cardenas-Blanco A, Brodersen KH, Enno Stephan K, Düzel E (2014b) Laminar activity in the hippocampus and entorhinal cortex related to novelty and episodic encoding. Nat Commun5:5547.
- Maass A, Berron D, Libby L, Ranganath C, Düzel E (2015) Functional subregions of the human entorhinal cortex. Elife4.
- Maass A, Düzel S, Brigadski T, Goerke M, Becke A, Sobieray U, Neumann K, Lövdén M, Lindenberger U, Bäckman L, Braun-Dullaeus R, Ahrens D, Heinze H-J, Müller NG, Lessmann V, Sendtner M, Düzel E (2016) Relationships of peripheral IGF-1, VEGF and BDNF levels to exercise-related changes in memory, hippocampal perfusion and volumes in older adults. NeuroImage131:142–154.
- Maass A, Landau S, Baker SL, Horng A, Lockhart SN, Joie RL, Rabinovici GD, Jagust WJ, Alzheimer’s Disease Neuroimaging Initiative (2017) Comparison of multiple tau-PET measures as biomarkers in aging and Alzheimer’s Disease. Neuroimage
- Maass A, Lockhart SN, Harrison TM, Bell RK, Mellinger T, Swinnerton K, Baker SL, Rabinovici GD, Jagust WJ (2018) Entorhinal tau pathology, episodic memory decline and neurodegeneration in aging. J Neurosci:2028–17.
- Maass A, Berron D, Harrison TM, Adams JN, La Joie R, Baker S, Mellinger T, Bell RK, SwinnertonK, InglisB, Rabinovici GD, Duzel E, Jagust WJ(2019)Tau and amyloid-βtarget specific memory domains in the aging brain. Brain(in press)
- Maass A &Shine S. (2019)Navigating the future of clinical assessments. Brain(in press)
- Wimber M, Maaß A, Staudigl T, Richardson-Klavehn A, Hanslmayr S (2012) Rapid memory reactivation revealed by oscillatory entrainment. Curr Biol22:1482–1486.
- WinerJR, Maass A, Pressman P, Stiver J, Schonhaut DR, Baker SL, Kramer J, Rabinovici GD, Jagust WJ (2017) Associations Between Tau, β-Amyloid, and Cognition in Parkinson Disease. JAMA Neurol
- Wisse LEM et al. (2017) A harmonized segmentation protocol for hippocampal and parahippocampal subregions: Why do we need one and what are the key goals? Hippocampus 27:3–11
Book chapter and Reviews
- Düzel E, Guitart-Masip M, Maass A, Hämmerer D, Betts MJ, Speck O, Weiskopf N, Kanowski M (2015) Midbrain fMRI: Applications, Limitations and Challenges. In: fMRI: From Nuclear Spins to Brain Functions (Uludag K, Ugurbil K, Berliner L, eds), pp 581–609 Biological Magnetic Resonance. Boston, MA: Springer US.
- Schöll* M, Maass* A, Mattsson N, AshtonN, Blennow K, Zetterberg H, Jagust W. Biomarkers for tau pathology (2018). Molecular and Cellular Neuroscience (* both authors contributed equally to the work)





